S’informer de la chimie cellulaire. La chimie étudie la composition de la matière et ses transformations. La chimie s’intéresse ainsi aux éléments qui constituent la matière (atomes, ions, etc.), à leurs propriétés et aux liaisons chimiques qui peuvent se créer entre eux.
La chimie cellulaire
La chimie est une science de la nature expérimentale qui étudie la composition de la matière et ses transformations. La chimie s’intéresse ainsi aux éléments qui constituent la matière (atomes, ions, etc.), à leurs propriétés et aux liaisons chimiques qui peuvent se créer entre eux.
La chimie de la cellule.
• Les atomes.
• Les molécules et les liaisons chimiques.
• Les solutions et leurs propriétés.
• Les composés organiques et inorganiques.
Toute la matière vivante ou non, est constituée d’unités de base, les éléments chimiques . Le corps est constitué à 96% de carbone (C), d’azote (N), d’oxygène (O), et d’hydrogène (H). Le corps contient 3% de calcium (Ca), de phosphore (P), de potassium (K), et de soufre (S) .Le reste du corps est constitué de petites quantités de fer (Fe), de clore (Cl), d’Iode (I), de sodium (Na), de magnésium (Mg), de cuivre (Cu), de manganèse (Mn), de cobalt (Co), de zinc (Zn), de chrome (Cr), de fluor (F), de molybdène (Mo) de silicium (Si), et de sélénium (Se), que l’on appelle des oligo-éléments ( éléments traces).
Les atomes.
Définition : L’atome est la plus petite unité de base d’un élément qui conserve les propriétés de cet élément. Chaque élément pur est composé d’un seul type d’atome.
Un atome est composé de trois sortes de particules élémentaires :
- Les protons : de charge +1, de masse 1.
- Les neutrons : de charge nulle, de masse 1.
- Les électrons : de charge -1, de masse très petite.
- Le noyau de l’atome contient des protons et des neutrons.
Le nombre atomique (Z) = nombre de protons dans le noyau.
La masse atomique = nombres de protons + nombre de neutrons. (Soit 2 fois le nombre atomique).
Le nombre atomique est le même pour tous les atomes d’un même élément chimique. Autour du noyau il y a exactement Z électrons, ce qui confère à l’atome une charge électrique globale nulle. Les électrons se trouvent en orbite autour du noyau, comme les planètes systèmes solaires sont en orbite autour du soleil. Les électrons se répartissent selon des niveaux énergétiques, les couches électroniques. Les quatre premières couches peuvent contenir 2, 8, et 18 électrons. Les électrons se positionnent un par un sur une couche donnée, les couches les plus internes devant être remplies complètement avant que la couche suivante ne commence à se remplir.
Les molécules et les liaisons chimiques
Définition : une molécule est une combinaison de deux atomes ou plus qui sont reliés les uns les autres par une liaison chimique.
Les molécules constituent les unités élémentaires des composés chimiques comme les atomes sont les plus petites unités d’un élément chimique. L’eau est un composé chimique essentiel de la vie. Elle est constituée de molécules contenant chacune un atome d’oxygène et de deux atomes d’hydrogène (H2O). Les nombres en indice dans la notation chimique, indiquent le nombre d’atomes de chaque élément dans une molécule du composé.
Une molécule résulte de la formation de liaisons, forces d’attraction, entre les atomes qui la constituent. Une liaison ionique se forme entre deux atomes dont l’un, qui a perdu des électrons, est chargé positivement, et l’autre qui gagne des électrons, est chargé négativement. Les atomes chargés sont des ions, et ceux qui portent des charges négatives sont fortement attirés par ceux qui portent des charges positives (figure 1).
Figure 1 La formation d’une liaison ionique dans la molécule de NaCl (chlorure de sodium)

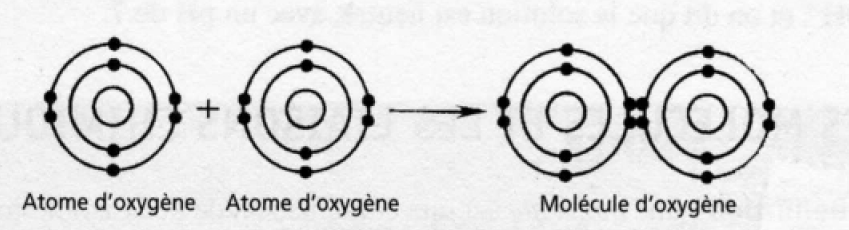
Les liaisons covalentes se forment entre les atomes qui partagent les mêmes électrons (figure 2). Un atome d’hydrogène engagé dans une liaison covalente avec un atome électronégatif, l’atome d’oxygène par exemple, gagne une charge positive faible. Une liaison d’hydrogène est une interaction qui s’établit entre cet atome d’hydrogène (légèrement positif) engagé dans une liaison covalente, et un autre atome électronégatif, comme l’oxygène, engagé dans une autre liaison. Des réactions chimiques se produisent quand les molécules sont formées ou dégradées, ou que par arrangements atomiques se produisent.
Figure 2 La formation d’une liaison covalente dans la molécule de O2 (oxygène)
Les solutions et leurs propriétés.
Lorsque deux substances ou plus s’associent sans former de liaisons entre elles, elles constituent un mélange. Les solutions sont des mélanges dans lesquels les molécules de toutes les substances qui les constituent y sont distribuées de façon homogène. Des solutions comme l’eau salée sont constituées d’une phase solide (le soluté) dans un liquide (lesolvant). La concentration en soluté d’une solution peut être exprimée de différentes façons ; selon le pourcentage de soluté dans la solution, ou selon la molarité en soluté de la solution, qui correspond au nombre de moles de soluté par litre de solution (1 mole =6,022 x 1023 molécules).
Une des propriétés importantes des solutions est leur caractère acide ou basique (alcalin). Cette propriété est mesurée par le pH de la solution.
Dans n’importe quel échantillon d’eau, il existe une proportion de molécules d’eau ionisées, sous forme de protons de H+ (ions hydrogène) et d’OH- (ions hydroxyde). Dans de l’eau pure de nombre de H+ est égal au nombre d’OH-, et on dit que la solution est neutre, avec un pH de 7.
D’après la théorie d’Arrhénius :
Un acide est une substance qui augmente la concentration en ions H+ d’une solution. Le pH d’un acide est inférieur à 7.
Une base est une substance qui augmente la concentration en ions OH- d’une solution. Le pH d’une base est supérieur à 7 et inférieur ou égal à 14.
Plus la valeur du pH est basse, plus l’acidité de la solution est élevée.
Plus la valeur du pH est élevée, plus l’alcalinité de la solution est élevée.
Définition : un sel est un composé ionique produit par la réaction entre un acide et une base. Lorsqu’un acide perd un proton (H+) et qu’une base perd un hydroxyde (OH-), les ions qui sont produits , réagissent parfois pour former un sel. Exemple :
HCl (acide) + NaOH (base) –> H2O (Eau) + NaCl (Sel)
Définition : un tampon est réalisé par la combinaison d’un acide faible et de sa base conjuguée (ajoutée sous forme de sel), ce qui permet de maintenir constant le pH de la solution.
Lorsqu’une solution contient un tampon, l’addition d’un acide fort ou d’une base forte n’entraine pas de variation importante de son pH. Lorsqu’un acide est ajouté à la solution tamponnée, il est neutralisé par la base conjuguée. Lorsqu’une base est ajoutée à la solution tamponnée, l’acide faible lui même neutralise la base.
Les trois systèmes tampons les plus importants de l’organisme sont : le tampon bicarbonate/acide carbonique dans le sang et les liquides extracellulaires, le tampon phosphate disodique / phosphate monosodique dans les reins et les liquides intracellulaires et le tampon protéinate / protéines que l’on trouve dans les tissus.
Les composés organiques et inorganiques.
Les composés organiques ne contiennent pas de Carbone (sauf CO et CO2) et sont en général de petites molécules. Les composés organiques contiennent toujours du carbone et sont formés par liaison covalente. Les composés organiques sont en général des molécules complexes et de grande taille. Les composés organiques et inorganiques jouent tous les deux un rôle important dans les réactions chimiques des êtres vivants.
Dans les organismes vivants on trouve les composés inorganiques suivants : l’eau, le dioxyde de carbone, des sels, des acides, des bases et des électrolytes, comme le sodium (Na), le potassium (K+), le calcium (Ca2+), et le clore (Cl–). Ces électrolytes ont un rôle important dans la transmission de l’influx nerveux, le maintien des caractéristiques des fluides du corps et pour l’accomplissement des activités hormonales et enzymatiques.
Les quatre familles de composés organiques:
- Les glucides : Composés de carbone, d’oxygène et d’hydrogène. Classés en monosaccharides, disaccharides et polysaccarides
- Les Lipides Composés d’acides gras et de Glycérol.
- Les proteines, Composés d’acides aminés. La propriété d’une protéine est déterminée par les propriétés des acides aminés qui la constituent.
- Les acides nucléiques Composés de nucléotides contenant du phosphate, un ose et une base azotée.
Les acides nucléiques comme l’acide désoxyribonucléique (ADN) et l’acide ribonucléique (ARN) sont formés de nucléotides. Un nucléotide est formé de trois éléments : un groupement phosphatase, un pentose, et une base azotée. Le pentose qui participe à la composition de l’ADN est toujours le désoxyribose et celui que l’on trouve dans l’ARN est le ribose. Le groupement phosphate est toujours le même d’un nucléotide à un autre mais dans l’ADN la base peut être soit l’Adénine (A), la Thymine (T), la Guanine (G) ou la Cytosine (C). Dans l’ARN, l’Uracile (U) remplace la thymine. L’ADN et l’ARN sont des macromolécules formées d’un enchainement de nucléotides.
Explorer :
A lire aussi:
- Le squeletteS’informer du squelette, la structure et la fonction des os, le développement des os, les os du squelette axial, les os du système appendiculaire, et les articulations. Articles récents. Le squelette Sommaire La structure et la fonction des os. Le développement des os. Les os du squelette axial. Les os du système appendiculaire. Les articulations. […]
- Grossesse et allaitementQuel est l’objectif de ce PDF? L’objectif principal de ce livre est d’assister les professionnels de la santé dans leurs prises de décisions quant à la pharmacothérapie des femmes qui planifient une grossesse, qui sont enceintes ou qui allaitent. Grossesse et allaitement Quel est l’objectif de ce livre ? L’objectif principal de ce livre est […]
- Le tissus osseux et les osS’informer des tissus osseux, comme tous les tissus conjonctifs, sont constitués de cellules fixes ( ostéoblastes – ostéocytes ) ou étrangères (ostéoclastes) , et d’une matrice extracellulaire ou substance osseuse formée de calcium. Le tissus osseux et les os La matrice osseuse, ou ostéoïde, est le tissu qui entoure les cellules osseuses. Elle contient des […]
- Le systeme tégumentaireS’informer des téguments comme revêtement externe du corps humain. S’informer de la peau et ses annexes telles que les phanères : poils, cheveux, ongles. La principale fonction des téguments est de protéger l’organisme des agressions du milieu extérieur. Le systeme tégumentaire Les téguments constituent le revêtement externe du corps. Chez l’être humain, il s’agit de […]
- Les tissusC’esst quoi un tissu en biologie ? C’est le niveau d’organisation intermédiaire entre la cellule et l’organe. Un tissu est un ensemble de cellules semblables et de même origine, regroupées en amas, réseau ou faisceau (fibre) et exerçant la même fonction. Les tissus Un tissu en biologie est le niveau d’organisation intermédiaire entre la cellule […]
- La celluleC’est quoi une cellule? Une cellule est l’unité de base de tout organisme (excepté les virus). Sa membrane permet de créer une entité, séparée des autres cellules dans le cas des organismes pluricellulaires. La cellule Une cellule est l’unité de base de tout organisme (excepté les virus). Sa membrane permet de créer une entité, séparée […]
- La chimie cellulaireS’informer de la chimie cellulaire. La chimie étudie la composition de la matière et ses transformations. La chimie s’intéresse ainsi aux éléments qui constituent la matière (atomes, ions, etc.), à leurs propriétés et aux liaisons chimiques qui peuvent se créer entre eux. La chimie cellulaire La chimie est une science de la nature expérimentale qui […]
- Le corps humainQu’est ce qu’un corps humain? Le corps humain a toujours besoin de l’oxygène pour produire de l’énergie à partir des nutriments et la pression pour permettre la respiration. Cette chaleur servira pour favoriser les réactions chimiques. Le corps humain Le corps humain est constitué de plusieurs systèmes (nerveux, digestif, etc.), ainsi que de 206 os et […]
[pt_view id= »8ac61a5tdv »]